Design physiologisch stabiler, zytotoxischer RNase A-Tandemenzyme
Projektleiter:
Finanzierung:
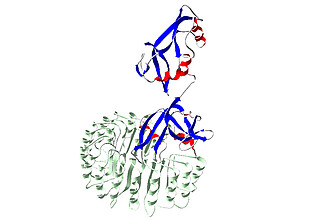
Ribonucleasen (RNasen) stellen aufgrund ihrer Zytotoxizität potentielle Tumortherapeutika dar. Wirksame RNase-Enzympräparate müssen dazu ihre katalytische Aktivität (Spaltung von Ribonucleinsäuren) unter physiologischen Bedingungen beibehalten. Das bedeutet, dass sie durch den zelleigenen Ribonucleaseinhibitor (RI) nicht inaktiviert werden dürfen und unter physiologischen Bedingungen eine ausreichend hohe Stabilität besitzen müssen. Dazu sollen hier auf gentechnischem Weg zwei RNase A-Moleküle mittels Peptidlinker fusioniert werden, wodurch es bei diesen sog. Tandemenzymen aus sterischen Gründen zu einer verminderten RI-Bindung kommen sollte, so dass ihre enzymatische Aktivität (= Zytotoxizität) erhalten bleibt. Dem Design des Peptidlinkers gilt besondere Aufmerksamkeit, da dieser die biochemischen und biophysikalischen Eigenschaften der Tandemenzyme entscheidend prägen sollte.Neben der Gewinnung neuer Therapeutika sind Erkenntnisse über die Konstruktion und Gewinnung von RNase A-Tandemenzymen sowie deren Struktur und Wechselwirkung mit dem Inhibitor zu erwarten.
Schlagworte
Ribonuclease, Stabilität, Tandemenzym, Tumortherapie, Zytotoxizität
Kontakt

PD Dr. Ulrich Arnold
Martin-Luther-Universität Halle-Wittenberg
Naturwissenschaftliche Fakultät I
Institut für Biochemie und Biotechnologie
Kurt-Mothes-Str. 3
06120
Halle (Saale)
Tel.:+49 345 5524869
weitere Projekte
Die Daten werden geladen ...


