Hemmstoffe von Histon-Arginin Methyltransferasen als Wirkstoffe in der Tumortherapie
Projektleiter:
Projektbearbeiter:
Dina Robaa,
Benjamin Sauer
Finanzierung:
Haushalt;
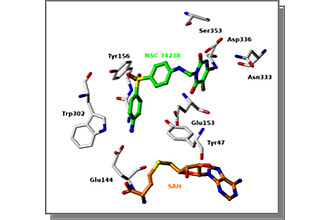
Posttranslationale Modifikationen der Seitenketten von Aminosäuren in Histonen liefern einen wichtigen Beitrag zu Genregulation und Signaltransduktion und stellen neue Targets für die onkologische Wirkstoffforschung dar. Wichtige Beispiele sind die reversible Acetylierung von Lysinen oder die Methylierung von Lysinen und Argininen. Hemmstoffe von Histon-Desacetylasen (HDAC) befinden sich bereits in klinischen Studien zur Testung als neue Krebstherapeutika. Der HDAC-Inhibitor Vorinostat ist als ZolinzaTM Ende 2006 für die Krebstherapie (CTCL) zugelassen worden. Die Kenntnisse über die Proteinmethylierung und ihre Bedeutung ist im Vergleich zur Acetylierung deutlich geringer ausgeprägt, was unter anderem auch auf den Mangel an potenten und selektiven Hemmstoffen zurückzuführen ist. Wir konnten neue Hemmstoffe der Arginin-Methyltransferasen (PRMTs) identifizieren, die ebenso wie der bislang einzige beschriebene Inhibitor in einem Reportergenmodell die ligandenabhängige Aktivierung hormonabhängiger Rezeptoren blockieren. Diese Inhibitoren stellen daher potentielle neue Wirkstoffe für die Therapie hormonabhängiger Tumoren dar. Dieses Projekt hat die Entwicklung optimierter PRMT- Inhibitoren und die Abklärung ihres therapeutischen Potentials für die Onkologie zum Inhalt. Dabei sollen androgenabhängige Tumoren im Mittelpunkt der Untersuchung stehen. Es sollen weitere Leitstruktren für PRMTs identifiziert und vorhandene Hemmstoffe auf ihre Wirkpotenz und selektivität hin optimiert werden. Zusätzlich sollen über ein virtuelles Screening von 3,6 Mio verfügbarer Verbindungen weitere Inhibitoren identifiziert werden. Der Schwerpunkt auf der Wirkstoffseite soll auf der Optimierung der bereits identifizierten Hemmstoffe liegen. Mit den in den Vorarbeiten bereits etablierten theoretischen Modellen können Vorschläge für eine systematische strukturelle Abwandlung der Leitstrukturen gemacht werden. Wir verfügen über Enzyminhibitions- und Methylierungsassays, die eine effektive Rückkopplung zur weiteren Syntheseplanung erlauben.
Schlagworte
Histone, Methyltransferasen, PRMT1, Tumortherapie, virtuelles Screening
Kontakt

Prof. Dr. Wolfgang Sippl
Martin-Luther-Universität Halle-Wittenberg
Naturwissenschaftliche Fakultät I
Wolfgang-Langenbeck-Str. 4
06120
Halle (Saale)
Tel.:+49 345 5525040
weitere Projekte
Die Daten werden geladen ...

